Was führt zu Impfversagen und welche neuen Therapien sind möglich?
Worum geht es in diesem Forschungsprojekt?
Eine Impfung ist der beste Schutz gegen Hepatitis B. © Deutsche Leberstiftung
Worum geht es in diesem Forschungsprojekt?
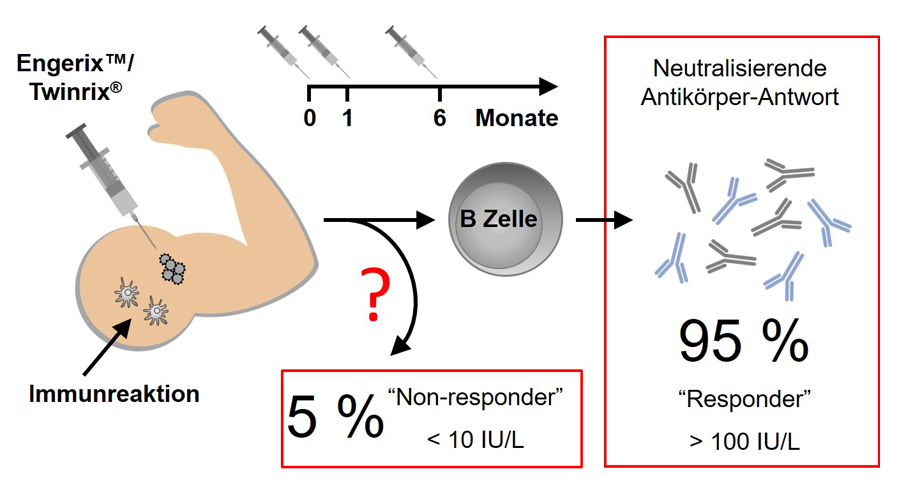
Die Infektion mit dem Hepatitis B Virus (HBV) verläuft häufig chronisch und damit können Leberzirrhosen und ein erhöhtes Risiko für die Entwicklung eines Leberzellkarzinoms einhergehen. HBV-Vakzine gelten als hochwirksam und finden weltweit Anwendung. Jedoch werden bei etwa 5 % der HBV-Vakzinierten nach Applikation des Impfstoffes keine protektiven Antikörper gebildet, sodass trotz Impfung kein Schutz vor einer HBV-Infektion besteht (sog. „Non-Responder“). Anders als beispielsweise bei der Grippeimpfung, bei welcher eine geringe Impfantwort vorrangig bei älteren Menschen beobachtet wird, ist das Impfversagen nach HBV-Impfung nicht durch ein hohes Alter zu erklären: Auch junge Erwachsene sind davon betroffen. Die Faktoren, welche die Impfantwort beeinflussen, sind bislang noch weitestgehend ungeklärt und schlecht verstanden.
Wie ist der Stand der Dinge?
Abgesehen von der ausbleibenden HBV-spezifischen Immunreaktion konnten bislang keine offensichtlichen Anomalien im Immunsystem von Non-Respondern festgestellt werden. Insbesondere wurden normale Reaktionen auf viele andere Vakzine und Antigene bei HBV-Non-Respondern beobachtet, sodass nicht von einem generellen Immundefekt auszugehen ist. Es sind nur wenige molekulare Parameter bekannt, die zum Non-Responder-Status beitragen.
Basierend auf SNP-Typisierungen und Genome Wide Association Studies konnten verschiedene genetische Komponenten des angeborenen und des adaptiven Immunsystems mit dem Phänomen assoziiert werden. Trotzdem steht weder ein umfassendes Modell zur Erklärung des Impfversagens zur Verfügung, noch konnten bislang Biomarker zur Erkennung potentieller Non-Responder identifiziert werden. Demzufolge wurde bislang kein Impfschema etabliert, welches in einer erfolgreichen Impfung der Non-Responder resultieren würde. Dies stellt unter anderem eine große Herausforderung für das Pflegepersonal dar, da der enge und häufige Kontakt zu verschiedensten Patienten eine HBV-Impfung erforderlich macht.
Eine weitere Herausforderung ist die Tatsache, dass bislang nicht geklärt werden konnte, ob die relativ wenigen Patientinnen und Patienten, die eine chronische Infektion entwickeln nachdem sie im Erwachsenenalter mit dem Erreger in Kontakt gekommen sind, ebenfalls Vakzine-Non-Responder sind. Generell kann die Vermehrung der Viren durch antivirale Behandlung gehemmt werden, das Virus kann jedoch aufgrund der Toleranz des Immunsystems nicht mehr eliminiert werden und die chronische Infektion bleibt bestehen.
Wie kommen wir da hin?
In Zusammenarbeit mit den Betriebsärztinnen und -ärzten der MHH bauen wir Kohorten auf, die aus Respondern und Non-Respondern auf die HBV-Impfung bestehen. Dies ist als Grundstein für die Analyse der molekularen Faktoren hinsichtlich des Impfversagens nach HBV-Vakzinierung anzusehen. Zurzeit erfolgen erste Immunomonitoring-Studien in HBV-Respondern und Non-Respondern. Zudem werden Genomsequenzierungen und HLA-Typisierungen durchgeführt, um die genetischen Charakteristika zu bestimmen, die mit Non-Respondern assoziiert werden.

Betriebsärztinnen und -ärzte der MHH arbeiten mit an diesem RESISIST-Projekt.