Warum verlaufen Infektionen mit Hanta- und Arenaviren so unterschiedlich?
Worum geht es in diesem Forschungsprojekt?
Die Infektion mit neu auftretenden zoonotischen Viren wie Mitgliedern der Arenavirus- und Hantavirus-Familien kann beim Menschen zu sehr unterschiedlichen Krankheitsmanifestationen führen, die von asymptomatischen Infektionen bis hin zu hochpathogenem hämorrhagischem Fieber reichen. Die Krankheitsdeterminanten sind nicht gut verstanden.
Ziel dieses Projekts ist es, die Wirts- und Virusfaktoren zu verstehen, die der Immunaktivierung und der variablen Krankheitsmanifestation zugrunde liegen, und herauszufinden, wie diese für die Entwicklung neuer und individueller antiviraler Behandlungsmöglichkeiten genutzt werden können.
Wie ist der Stand der Dinge?
Zwar werden jährlich nur etwa 100.000 Fälle von Hantavirus-Infektionen und bis zu 300.000 Fälle von Lassa-Fieber, der häufigsten mit Arenaviren assoziierten Krankheit, registriert, doch sind die tatsächlichen Fallzahlen aufgrund einer großen Zahl asymptomatischer oder milder Infektionen, die anderen grippeähnlichen Erkrankungen ähneln, höchstwahrscheinlich deutlich höher. Es wird beispielsweise geschätzt, dass 2-5 % der Weltbevölkerung schon einmal mit LCMV, einem meist apathogenen Arenavirus, infiziert waren.
Trotz ihrer potenziellen Prävalenz und Pathogenität gibt es derzeit keine von der FDA oder EMA zugelassenen antiviralen Behandlungen oder Impfstoffe gegen hochpathogene Hantavirus- oder Arenavirus-Infektionen, wobei lediglich Ribavirin und Favipiravir bei einigen Patientinnen und Patienten eine begrenzte Wirksamkeit gezeigt haben. Das Verständnis der Mechanismen der Krankheitsentstehung ist für die Entwicklung neuartiger und individueller antiviraler Behandlungsmöglichkeiten von entscheidender Bedeutung.
Wie kommen wir da hin?
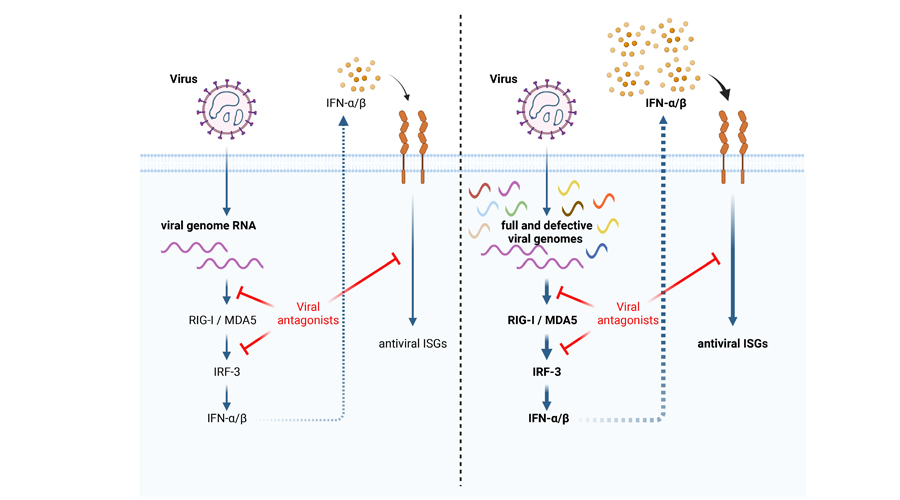
Unsere Vorarbeiten zeigen, dass eine abweichende virale Replikation und die Bildung defekter viraler Genome (DVGs) ein universelles Merkmal von RNA-Viren mit negativem Sinn sind und dass diese DVGs die Interferonantwort des Wirts stark stimulieren. Daher möchten wir die Mechanismen, die die DVG-Synthese regulieren, und die Konsequenzen für die virale Pathogenese neu auftretender RNA-Viren analysieren.
Hier verfolgen wir einen Multi-omics-Ansatz, der durch Virus-Engineering und molekularbiologische Werkzeuge ergänzt wird, um das gesamte virale Transkriptom/Replikom zu charakterisieren und den Zusammenhang zwischen spezifischen viralen PAMPs und Immunaktivierung in vitro und in vivo zu identifizieren.
Zur Abbildung: Links ist zu sehen, dass die RNA des Hantavirus (viral genome RNA) von zellulären RNA-Sensoren erkannt wird. Das löst eine Interferon (IFN)-Reaktion aus, die in der Aktivierung antiviraler Gene gipfelt. Virale IFN-Antagonisten können die IFN-Signalisierung hemmen. Rechts ist zu sehen, dass während der viralen Replikation abweichende Replikationsprodukte/defekte virale Genome in großer Zahl akkumulieren. Sie können das angeborene Immunsystem des Wirts überwältigen, was zu einer verlängerten und übermäßigen IFN-Antwort führt. So kann es zu hochgradig entzündlichen und krankhaften Infektionen kommen.