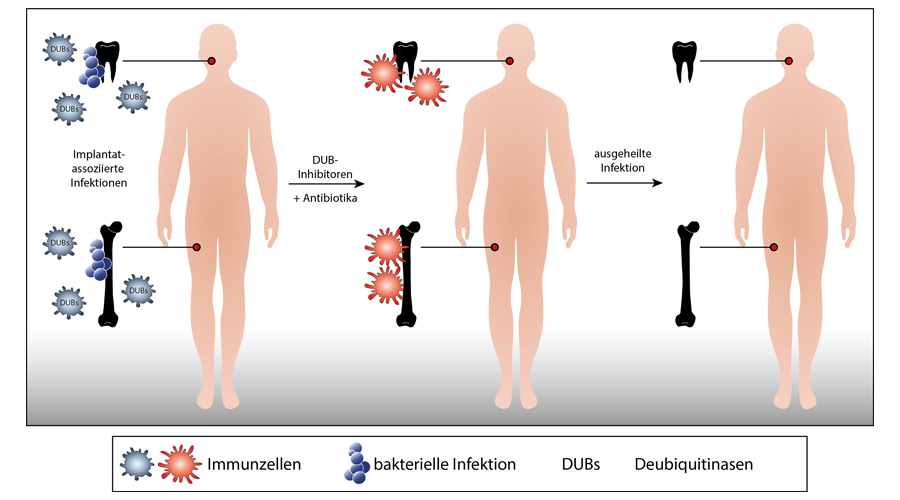
Bei bakteriellen Infektionen können so genannte Ubiquitine eine wichtige Rolle spielen. Sind sie ein neuer Ansatz für Therapien?
Worum geht es in diesem Forschungsprojekt?
Das Risiko und der Verlauf schwerer bakterieller Infektionen werden insbesondere durch das Wechselspiel zwischen dem spezifischen Bakterium und dem infizierten Menschen determiniert. Auf Seiten des Menschen bestimmen Faktoren wie eine zugrundeliegende Immunschwäche, das Alter und das Vorhandensein von Implantaten das Infektionsrisiko. Bakterielle Infektionserreger nutzen diese Immunschwächen, infizieren den Menschen und lösen Infektionen aus. Gleichzeitig schwächen praktisch alle relevanten bakteriellen Erreger aktiv das Immunsystem des Infizierten und verstärken damit die Infektion. Aufgrund der zunehmenden Resistenz der Bakterien gegenüber Antibiotika stellt die Verhinderung der Schwächung des Immunsystems und seine Stärkung eine innovative therapeutische Option dar.
Wie ist der Stand der Dinge?
Um auf eine Infektion reagieren zu können, verfügt das Immunsystem über ein System aus Rezeptoren, die den Menschen infizierende Bakterien erkennen. Bei Aktivierung dieser Rezeptoren werden in den Immunzellen Abwehrmechanismen ausgelöst, die innerhalb von Minuten antibakterielle Immunreaktionen auslösen. Diese Immunreaktionen sind entscheidend von der postranslationalen Modifikation von Wirtszellproteinen abhängig. Dazu zählt die Ubiquitinierung von Wirtszellproteinen, bei denen entweder Ubiquitinmoleküle an das Protein angelagert oder abgespalten werden. Auch bei länger anhaltenden und chronischen Infektionen ist der Ubiquitinierungsstatus immunologisch wichtiger Signalmoleküle in Immunzellen und auch in infizierten Zellen von grundlegender Bedeutung für den Infektionsverlauf. Aus diesem Grunde haben zahlreiche Bakterien auch Mechanismen entwickelt, um die Ubiquitinierung von Wirtsproteinen zu manipulieren. Eine therapeutische Beeinflussung der Ubiquitinierungsvorgänge ermöglicht potentiell die Behandlung von Infektionen über Antibiotika hinaus.
Das Immunsystem muss sich gegen krankheitserregende Bakterien wehren. Das Foto zeigt eine elektronenmikroskopische Aufnahme des Bakteriums Acinetobacter baumannii. Quelle: Gudrun Holland; Färbung: Michael Laue/RKI
Wie kommen wir da hin?
Um das Potential Ubiquitin-modulierender Wirkstoffe als Therapeutika von Infektionen und von autoinflammatorischen Erkrankungen, die durch Bakterien getrieben werden, zu evaluieren, werden wir unsere Arbeiten zur funktionellen Bedeutung und der Funktion einzelner Domänen von DUBs weiterführen. Bereits jetzt konnten wir bei den DUBs TNFAIP3, CYLD und OTUB1 entsprechende Untersuchungen durchführen und zeigen, dass bestimmte Domänen dieser DUBs von fundamentaler Bedeutung für die erfolgreiche Kontrolle von bakteriellen Infektionen sind (Just et al., 2016; Wex et al., 2016; Wang et al., 2013; Wang et al., 2019; Nishanth et al., 2013). Zur Durchführung der Struktur-/Funktionsanalysen werden wir auch neue innovative Mausmodelle generieren.
Dabei werden wir etablierte experimentelle Modelle wie Listeria monocytogenes und Staphylococcus aureus-Infektionen verwenden. Wir kombinieren diese Infektionsmodelle mit Studien zur Funktion von DUBs und S. aureus bei der Atopischen Dermatitis, da bei der AD S. aureus vermehrt Infektion verursacht und die Atopische Dermatitis aggraviert (Kooperation T. Werfel, L. Rössner; Projekt A3, A4, B5, RESIST-Cohort). Diese Arbeiten zeigen, dass einzelne DUBs bei der AD vermehrt exprimiert werden und die Kontrolle von S. aureus durch Makrophagen abschwächen.
Auf Basis dieser Daten werden wir DUB-Inhibitoren entwickeln, die gegen bestimmte zuvor als relevant identifizierte Domänen von DUBs gerichtet sind, und in den zuvor genannten Modellinfektionen testen.

Elektronen-Mikroskop-Aufnahme von Listeria monocytogenes © Petra Kaiser/RKI