NLRs (NOD-like-Rezeptoren) initiieren die Abwehr gegen Krankheitserreger, können aber auch selbst schaden. Wie kann man sie therapeutisch nutzen?
Worum geht es in diesem Forschungsprojekt?
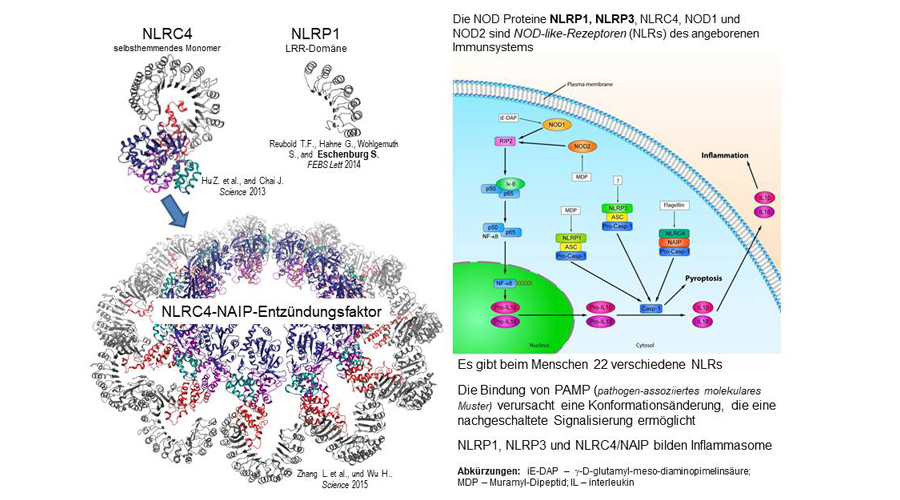
Ein wichtiger Bestandteil des angeborenen Immunsystems sind die sogenannten NLRs (NOD-like-Rezeptoren). Diese Immunrezeptoren erkennen eindringende Krankheitserreger innerhalb der menschlichen Zelle und veranlassen eine Entzündungsreaktion im betroffenen Gewebe, indem sie entzündungsfördernde Interleukine aktivieren. NLRs werden also bei einer Infektion mit Viren oder Bakterien alarmiert. Viele humanpathogene Keime beeinflussen jedoch die Wirksamkeit der Immunrezeptoren, um die Abwehrreaktion des Körpers zu behindern. Eine überschießende Aktivierung der NLRs, die als Komplikation bei vielen Virusinfektionen auftritt, verschlimmert den Verlauf der Erkrankung. Zahlreiche autoinflammatorische Störungen gehen auf eine irrtümliche Aktivierung von NLRs zurück, eine unerwünschte Dämpfung der NLR-Aktivität liegt vielen Immundefekten zugrunde.
Wie ist der Stand der Dinge?
In den letzten Jahren sind NLRs und speziell die Rezeptoren aus der Unterfamilie der NLRPs mehr und mehr in den Fokus der medizinischen Forschung gerückt. Trotz größter Anstrengungen zu verstehen, wie NLRs funktionieren und wie sie therapeutisch beeinflusst werden könnten, ist das Wissen über die molekularen Abläufe zur Aktivierung und Funktion von NLRs immer noch sehr begrenzt. Ebenso weiß man noch sehr wenig darüber, welche Rolle genetische Variationen in NLRs dabei spielen, wie anfällig ein Patient für bestimmte Infektionen ist und wie schwer der Verlauf der Infektion ist. Bis heute sind nur wenige Substanzen bekannt, die die Funktion einzelner NLRs gezielt beeinflussen könnten.

Wie kommen wir da hin?
Wir setzen ein breites Spektrum an zellbiologischen und strukturbiologischen Untersuchungsmethoden ein, um die Funktion von NLRPs in der Tiefe zu verstehen. Dabei werden wir die Dynamik des Aktivierungsprozesses abbilden, in dem wir die dreidimensionalen Strukturen des inaktiven Anfangszustandes und den aktiven oligomeren Endzustand ausgewählter NLRPs aufklären. Um die Endzustände von NLRPs darstellen zu können, werden wir Kryo-Elektronenmikroskopie in Kombination mit röntgenkristallographischen Methoden einsetzen. Um die inaktiven monomeren Anfangszustände ausgewählter Rezeptoren zu analysieren, wenden wir Röntgenkristallographie sowohl konventionell als auch als Serial Crystallography an, bei der polychromatische Synchrotronstrahlung zum Einsatz kommt. Am Beispiel des Kaposi-Sarcoma-Herpes-Virus (KSHV) und des Herpes-Simplex-Virus 1 (HSV-1) wollen wir zeigen, wie humanpathogene Viren die Funktion von NLRPs behindern. Wir konnten kürzlich in HEK293-Zellen bestätigen, dass das KSHV-Protein ORF63 die Funktion des Rezeptors NLRP1 durch direkte Wechselwirkung mit dem Rezeptor blockiert. Über Röntgenstrukturanalyse wollen wir die dreidimensionalen Strukturen von KSHV-ORF63 und vom entsprechenden Protein in HSV-1 aufklären, sowohl einzeln als auch im Komplex mit ihrem jeweiligen Ziel-NLRP. Um genetische Variationen in NLRPs zu identifizieren, die einen Einfluss auf die Funktion von NLRPs haben, werden wir, in Zusammenarbeit mit anderen Wissenschaftlern aus RESIST, die Informationen aus den Patientenkohorten in RESIST analysieren. Dafür werden wir auf Daten aus der HSV- und der Zoster-Kohorte zugreifen sowie auf Daten aus den Kohorten „Rheuma-VOR“ und KFO 250. Ebenso werden wir Daten der RSV-Kohorte IRIS nutzen und der Kohorte „Deutsches PID-NET“.
Mehr Informationen zu den einzelnen Kohorten finden Sie hier.