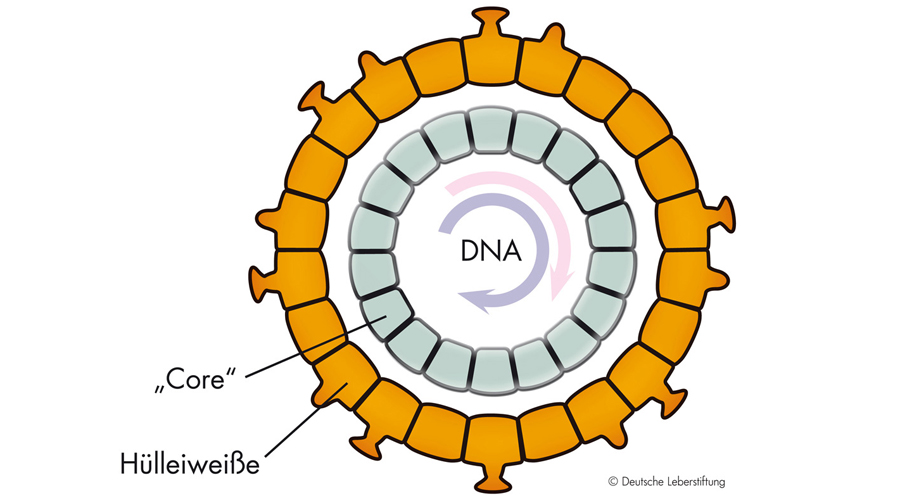
Warum heilt die Krankheit bei manchen Menschen spontan nach Therapieunterbrechung aus?
Worum geht es in diesem Forschungsprojekt?
Das Hepatitis-B-Virus (HBV) ist eine globale klinische Herausforderung. Weltweit sind mehr als 250 Millionen Menschen chronisch mit dem HBV infiziert, mit jährlich 650.000 HBV-bezogenen Todesfällen. Aktuelle Behandlungsmöglichkeiten für die chronische Hepatitis B in Industrieländern sind PEG-IFNα oder Nukleos(t)id-Analoga (NA). Die Therapie mit NA kann die Virusreplikation sehr effizient unterdrücken. Allerdings tritt nur bei einem kleinen Prozentsatz der Patientinnen und Patienten (weniger als 1% pro Jahr) ein Verlust von HBsAg (funktionelle Heilung von HBV) auf.
Wie ist der Stand der Dinge?
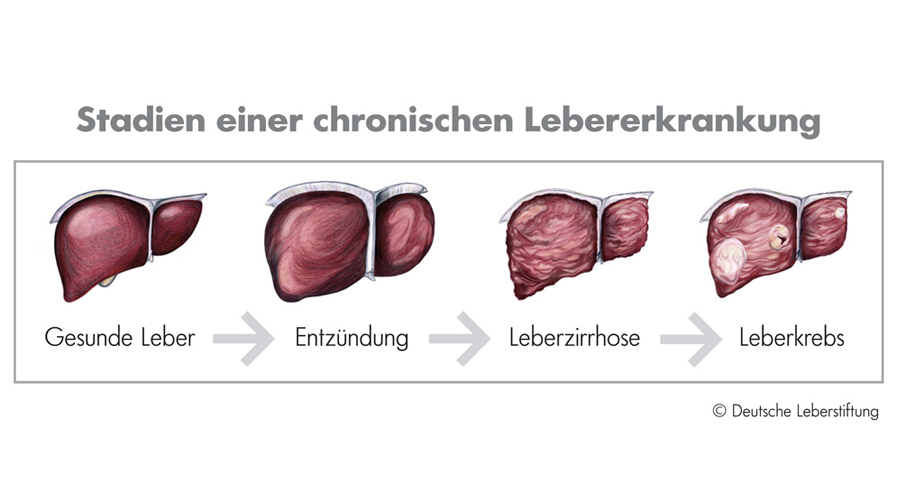
NA-behandelte Patientinnen und Patienten sind nach wie vor gefährdet, an Leberzirrhose, Leberversagen oder an einem hepatozellulärem Karzinom (HCC) zu erkranken, da die NA-Therapie nur die Entstehung neuer Hepatitis-B-Viren hemmt, aber die Entstehung von HBsAg und subviralen Partikeln nicht bzw. nur minimal beeinträchtigt. Auch hat die NA-Therapie keinen Einfluss auf die persistierende kovalent geschlossene kreisförmige HBV-DNA (cccDNA). Daher sind neue Strategien zur Reduktion von HBsAg erforderlich.
In früheren klinischen Studien schlugen Cornberg/Kraft eine Strategie zur Induktion von Hepatitis-Flares vor, bei der die NA-Therapie gestoppt oder unterbrochen wurde. Sie konnten zeigen, dass der kontrollierte NA-Behandlungsstopp bei HBeAg-negativen Patientinnen und Patienten sicher ist und bei bis zu 20 % der Betroffenen zu einem Abfall des HBsAg-Spiegels oder sogar zu einem Verlust des HBsAg führen kann. Bislang ist noch nicht ganz verstanden, welche Mechanismen an der erhöhten funktionellen Heilung bei Menschen mit NA-Behandlungsunterbrechung beteiligt sind. Zu diesem Zweck wurde eine zweite prospektive Studie (Terminator-2-Studie) initiiert, um mehr Patientinnen und Patienten zu gewinnen, die die Langzeit-NA-Therapie einstellen.
Wie kommen wir da hin?
Das Projekt basiert auf der Sammlung von Material aus der Hepatitis B-Kohorte und der Terminator-2-Studie. Vorläufige Ergebnisse zeigten, dass γδ T-Zellzahlen bei HBV-Patientinnen und Patienten im Vergleich zu gesunden Kontrollen erhöht sind. Bisher ist nichts über den Phänotyp, das TCR-Repertoire und das antivirale Potenzial von γδ T-Zellen bei Hepatitis B bekannt. Es ist zwar bekannt, dass HBV-spezifische αβ T-Zellreaktionen für die Kontrolle und Ausheilung von HBV wichtig sind, aber wir postulieren, dass auch γδ T-Zellreaktionen eine Bedeutung für virologischen Verlauf nach Beendigung der NA Therapie haben. Um die T-Zell-Reaktion im Verlauf von Infektionen zu überwachen, haben wir NGS-Technologien etabliert, die einen umfassenden Zugang zu komplexen Antigenrezeptor-Repertoires ermöglichen. Insbesondere haben wir eine Pipeline zur Untersuchung von γδ TCR-Repertoires durch RNA-basierte Multiplex-PCR-Amplikonsequenzierung und αβ TCR-Repertoires durch RNA-basierte 5′-RACE-PCR-Amplikonsequenzierung aufgebaut.
Blutproben von Hepatitis-Kranken werden eingescannt.