Tragen fortgeschrittenes Alter und Allergien zur Reaktivierung schlummernder Herpesviren bei?
Worum geht es in diesem Forschungsprojekt?
Ältere Menschen leiden unter geschwächten Immunantworten
Worum geht es in diesem Forschungsprojekt?
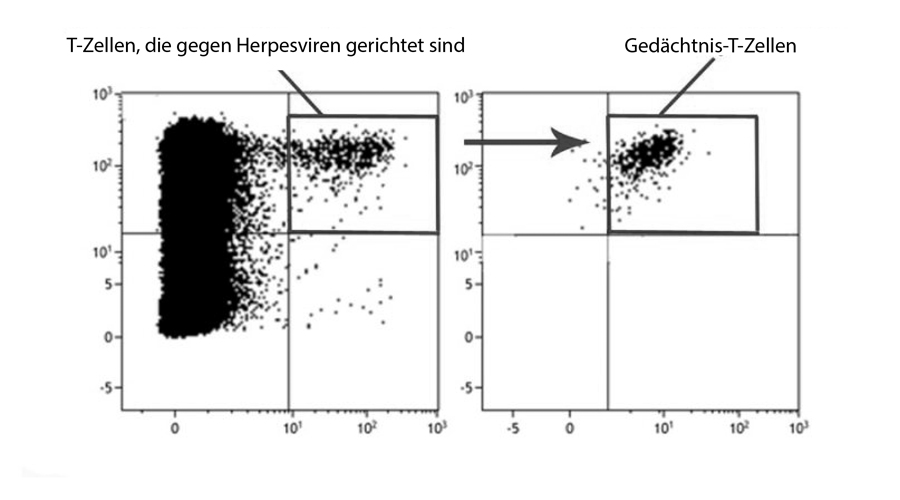
Ältere Menschen zeigen häufig ein beeinträchtigtes Ansprechen auf Impfstoffe. Dies lässt sich durch ein Altern des Immunsystems erklären, die so genannte Immunseneszenz. Hierbei verringert sich das Repertoire der verschiedenen Immunrezeptoren auf weißen Blutkörperchen (B-Zell- und T-Zell-Rezeptoren) und es reduziert sich dabei die Flexibilität des Immunsystems bei der Reaktion auf Krankheitserreger. Solche immunologische Seneszenz kann die Ursache von sekundären Ausbrüchen von latenten Varizella-Zoster-Virus (VZV) -Infektionen sein, die bei älteren Menschen mit einer relativ hohen Frequenz von 1,5 bis 5 zu 1000 auftreten. Interessanterweise scheint sich diese Häufigkeit bei Personen, die in der Kindheit gegen VZV geimpft wurden, nicht zu verringern.
Wie ist der Stand der Dinge?
Patientinnen und Patienten mit atopischen Erkrankungen („allergische“ Erkrankungen) sind oft anfälliger für Virusinfektionen. So zeigt beispielsweise eine Untergruppe von Menschen mit atopischer Dermatitis (AD, auch: Neurodermitis) eine erhöhte Anfälligkeit für das Herpes simplex Virus (HSV-1). Diese Erkrankung kann zu wiederkehrenden, schweren und ausgebreiteten Infektionen der Haut („Ekzema herpeticatum“) führen, die das Risiko einer gefährlichen Herpesenzephalitis bergen. Um dieses Problem zu lösen, stehen derzeit zwei VZV-Impfstoffe für Erwachsene zur Verfügung. Während ein Lebendimpfstoff mit einem abgeschwächten Stamm in etwa 51% der Fälle zu einem Schutz führt, wirkt ein neuer Impfstoff auf Basis eines rekombinanten Proteins in Kombination mit zwei Adjuvantien deutlich besser (>90% Schutz). Eine Untergruppe von Probanden, die in klinischen Studien nicht angesprochen haben, bleibt jedoch bestehen und diese Gruppe ist bisher nicht charakterisiert.
Wie kommen wir da hin?
Das Projekt basiert auf der Sammlung von bereits vorhandenen Bioproben, die von Patientinnen und Patienten mit Neurodermitis stammen. Hinzu kommen Bioproben, die wir derzeit im Rahmen der Zoster-Kohorte sowie der HSV-Kohorte sammeln. Dabei fungieren die Proben der RESIST-Studie mit der Allgemeinbevölkerung Hannovers als Kontrolle. Weiterhin werden Proben von älteren Menschen vor und nach der VZV-Impfung analysiert. Hier geht es vor allem darum, die antiviralen T-Zell-Antworten im Detail zu untersuchen.
Auf der Grundlage unserer langjährigen Erfahrung mit der angeborenen und adaptiven Immunität und den Entzündungsprozessen bei Menschen mit AD wollen wir hier die Immunantwort bei anfälligen Personen untersuchen. In früheren in vitro-Studien mit betroffenen Patientinnen und Patienten fanden wir erhöhte Frequenzen von T-Zellen gegen HSV-1, die eine wahrscheinlich ineffektive Immunantwort zeigten (Traidl et al. 2018). Diese Ergebnisse deuten darauf hin, dass das Atopie-geprägte entzündliche Milieu bei diesen Betroffenen zur Bildung von virusspezifischen T-Zellen führt, die eine suboptimale Immunantwort gegen Viren aufweisen. Mit der Anwendung unserer etablierten Methoden zur longitudinalen Charakterisierung der Dynamik von T-Zell-Antworten wollen wir pathogene αβ sowie γδ T-Zellen identifizieren und eine tiefe phänotypische und funktionelle Charakterisierung von diesen durchführen.