Welche Mechanismen führen bei Menschen mit Neurodermitis zu schweren Krankheitsverläufen nach Herpesinfektionen?
Worum geht es in diesem Forschungsprojekt?
Prof. Werfel erläutert, worum es in diesem Projekt geht.
Worum geht es in diesem Forschungsprojekt?
Die Alpha-Herpesviren Herpes-simplex-Virus Typ1 (HSV-1), HSV-2 und das Varizella-Zoster-Virus (VZV) sind Auslöser verschiedener Krankheiten, darunter schmerzhafte und stigmatisierende Gesichts-, Mund-, und Genitalläsionen bis hin zu lebensgefährlicher Enzephalitis und Meningitis. Erst- und wiederkehrende Infektionen führen darüber hinaus insbesondere bei Personen mit erhöhter Anfälligkeit, z.B. aufgrund genetischer Faktoren oder Immunsuppression, oder bei Älteren oder sehr jungen Menschen, zu erhöhter Morbidität und sogar Mortalität. HSV und VZV stehen im Blickpunkt der Forschung, da sie sind die häufigsten Ursachen für eine Infektion des Nervensystems darstellen, wobei zumeist das periphere Nervensystem, aber auch das Gehirn betroffen sein können. Langzeitfolgen umfassen u. A. die sog. Postherpetische Neuralgie, die die Lebensqualität noch Monate bis Jahre nach einer aktiven Zoster-Episode (Gürtelrose) einschränkt. Atopische, sog. „allergische“ Hauterkrankungen führen generell zu einer erhöhten Krankheitsanfälligkeit der Haut, insbesondere wird ein erhöhtes Risiko bezüglich Virusinfektionen beobachtet. In einer Untergruppe von schwer betroffenen Patientinnen und Patienten mit atopischer Dermatitis (AD) ist die großflächige Verbreitung von HSV in der Haut (Ekzema herpeticatum, EH), die lebensbedrohlich verlaufen kann, eine häufige Ursache für stationäre Behandlung.
Wie ist der Stand der Dinge?
Obwohl effektive Medikamente zur Behandlung von Alpha-Herpesvirus-Infektionen zur Verfügung stehen (wie z.B. Acyclovir, welches die virale Replikation blockiert), werden diese oft erst zu spät, also nach vollständiger Ausprägung klinischer Symptome, angewandt. Bezogen auf die Enzephalitis sind die Medikamentenspiegel im Gehirn oft zu niedrig um ausreichend effektiv zu wirken, wodurch von ausgeprägten HSV-Hautinfektionen Betroffene Risikopatientinnen und -patienten für diese schwere Komplikation sind.
Um neue Konzepte und Therapiestrategien zu entwickeln, wollen wir in diesem Projekt der Frage nachgehen, welche Charakteristika die Patientinnen und Patienten der Untergruppe aufweisen, die an erhöhter Anfälligkeit gegenüber viralen Infektionen leiden. In vorangegangenen Studien haben wir bereits humane Hautzellen (Keratinozyten) aus Haarfollikeln von Betroffenen gewonnen, die an einer AD und auch bereits an einem EH litten. Wir verglichen die HSV-1 Infektionsraten in diesen Zellen mit denen von Patientinnen und Patienten mit AD ohne EH in der Vergangenheit sowie mit solchen von gesunden Kontrollspendern. Diese Daten zeigen deutlich, dass die Keratinozyten der Patientinnen und Patienten mit EH am anfälligsten gegenüber HSV-1 sind. In früheren Studien beobachteten wir darüber hinaus, dass die Hautentzündung bei AD zu einer Schwächung der Hautbarriere führt (Seltmann et al. 2015) und zur Anfälligkeit gegenüber Viren beiträgt (Traidl et al. 2018). Um genetische Risikofaktoren zu identifizieren sammeln wir Proben (aktuell von mehr als 1.000 Menschen mit chronisch entzündlichen Hauterkrankungen, darunter 500 Personen mit AD) und führen genetische Analysen bei Patientinnen und Patienten mit AD und EH in der Krankheitsgeschichte durch.
Wie kommen wir da hin?
Uns stehen einzigartige Möglichkeiten zur Verfügung, um neue Immundefizienz-Faktoren zu identifizieren, die zur erhöhten Anfälligkeit gegenüber Alpha-Herpesvirus-Infektionen und/oder dem verschlimmerten Krankheitsverlauf beitragen. Wir kombinieren komplementären Sachverstand bezüglich Hautkrankheiten, Immunologie, klinischer Neurologie, Virologie, Zellbiologie und insbesondere der Genetik der Wirt-Pathogen-Beziehung.
Unsere Erfahrung in Zellkultursystemen bezüglich der relevanten Zelltypen für Alpha-Herpesvirus-Infektionen (Keratinozyten, Fibroblasten, Immunzellen und Nervenzellen) bilden die Grundlage bei der Entwicklung von experimentellen Modellen, um verschiedene Faktoren hinsichtlich einer erhöhten Anfälligkeit gegenüber Viren zu untersuchen. Dabei werden Kandidatenfaktoren hinsichtlich HSV-1 und HSV-2, VZV, Pockenimpfung (MVA) und Rhinovirus (RSV) erforscht.
Diesbezüglich soll ein Mausmodell entwickelt werden, an dem die Verbreitung des HSV-1 in der Haut sowie von der Haut in die Nervenzellen erforscht werden kann. In diesem System können identifizierte Faktoren gezielt manipuliert werden, um deren konkreten Einfluss auf den Verlauf der Infektion einschätzen zu können. Hinzu kommen Proben, die aktuell für die HSV-Kohorte gesammelt werden.
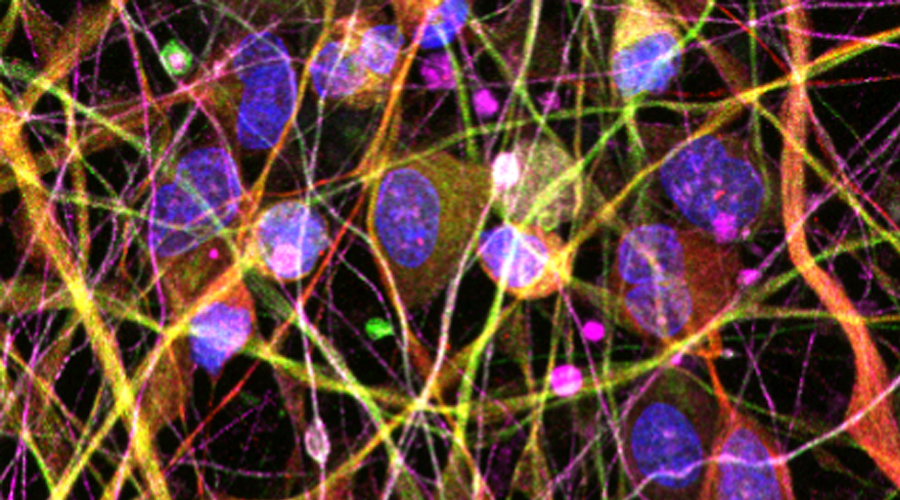
Menschliche Nervenzellen, die Marker exprimieren







