Welche individuellen menschlichen Faktoren begünstigen die Bildung von Biofilmen?
Worum geht es in diesem Forschungsprojekt?
Implantat-assoziierte Infektionen stellen ein ernstes Gesundheitsrisiko in Kliniken dar. Die Ursache sind Mikroorganismen, die biologische Oberflächen oder Oberflächen von dauerhaft implantierten Medizinprodukten besiedeln, und dort Biofilme ausbilden können. Bei Biofilmen handelt es sich um Ansammlungen von Mikroorganismen, die an hydratisierten Schnittstellen gebunden und in selbst produzierten extrazellulären Matrizen eingeschlossen sind. Sie stellen eine große Herausforderung bei der Behandlung von Patientinnen und Patienten dar. Bakterien in Biofilmen weisen veränderte Phänotypen in Bezug auf Wachstumsraten, Genexpressionsprofilen und Proteinproduktion auf. Eingebettet in ihre extrazelluläre Matrix bilden sie sowohl gegen Antibiotika als auch gegen die Effektormechanismen des Wirt-Immunsystems Resistenzen aus. Da die alleinige Verabreichung von Antibiotika für die Behandlung dieser Infektionen meist unwirksam ist, ist die Entfernung des infizierten Implantats zusammen mit der Verabreichung von Antibiotika die einzige Behandlungsmöglichkeit. Dies führt zu hohen Kosten und zu wiederholten Eingriffen bei Patientinnen und Patienten.
Wie ist der Stand der Dinge?
Die Zusammenhänge zwischen der Bildung bakterieller Biofilme auf Implantaten und dem Immunsystem des Wirtes wurden bisher nicht im Detail untersucht. So ist noch wenig über die Rolle des Immunsystems bei der Entwicklung von Implantat-assoziierten Biofilmen bekannt, die von S. aureus oder P. aeruginosa oder anderen pathogenen Bakterien produziert werden. Dies wäre jedoch für die Entwicklung von neuen Behandlungsstrategien von essentieller Bedeutung.
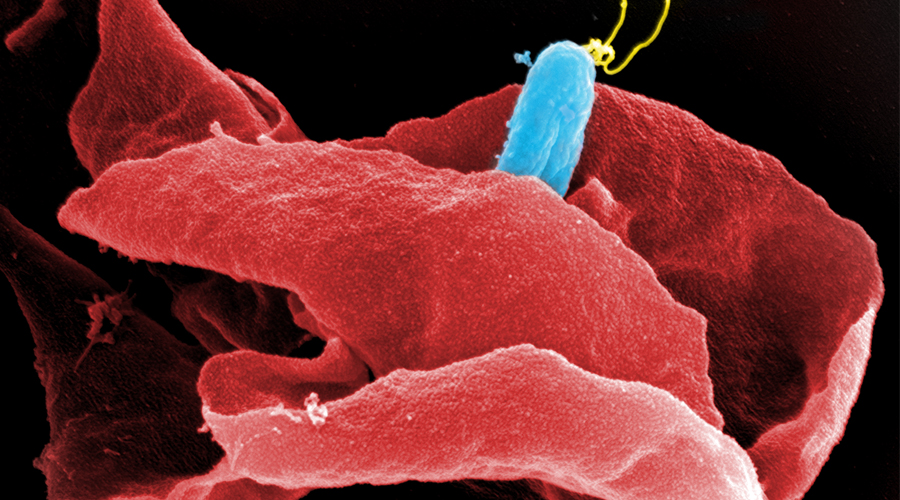
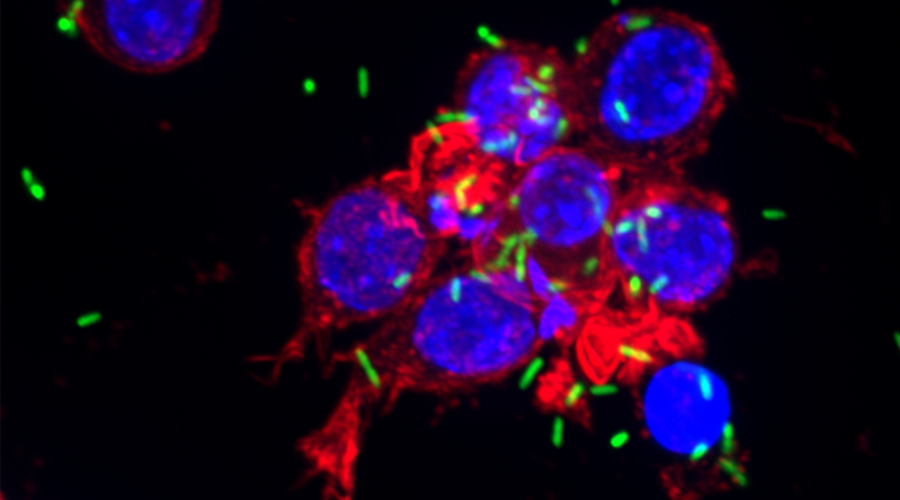
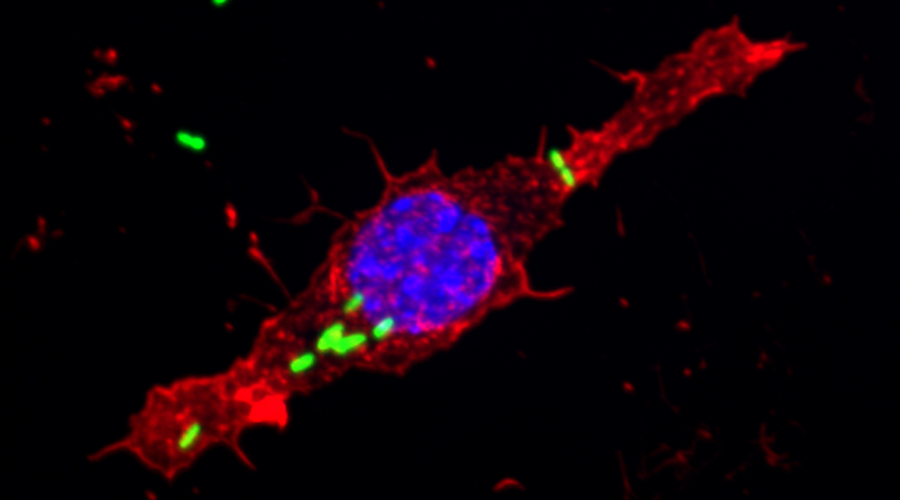
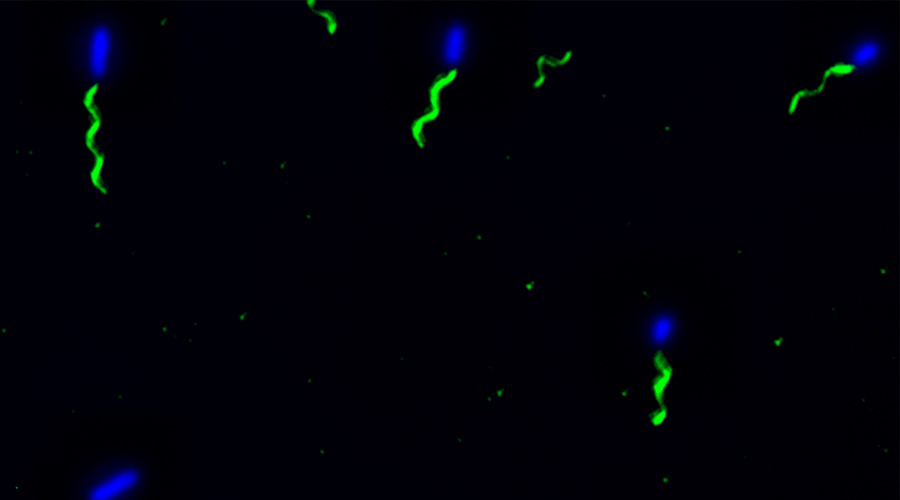
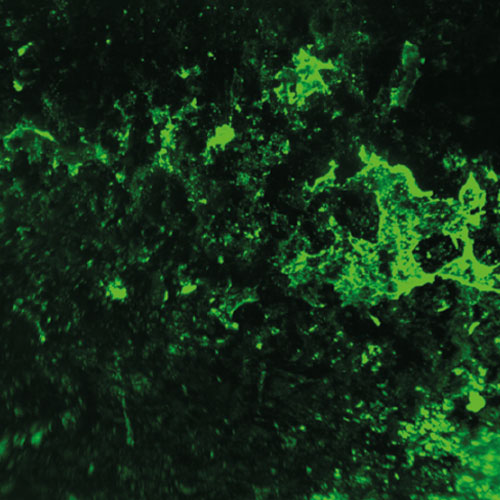
Für die Entwicklung eines Mausmodells zur Untersuchung Implantat-assoziierter Infektionen haben wir osmotische Pumpen mit S. aureus besiedelt und subkutan in C57Bl/6 Mäuse implantiert. Die Bakterien exprimierten eine bakterielle Luciferase, die es ermöglicht, ihre Expansion und die Entwicklung von Biofilmen durch den Einsatz nicht-invasiver Bildgebungsverfahren in vivo zu überwachen. Zudem wurde das Vorhandensein von Bakterienaggregaten und Biofilmen auf der Oberfläche der Implantate durch Immunfluoreszenz und Elektronenmikroskopie nachgewiesen. Darüber hinaus waren myeloische Zellen, darunter Neutrophile und Monozyten, zu den kolonisierten Pumpen eingewandert. Diese bildeten für die Bakterien eine Barriere zum das Implantat umgebenden Gewebe. Trotz der engen Nachbarschaft von Bakterien und myeloischen Zellen haben diese die Bakterien nicht phagozytiert. Lediglich die Eindämmung von Bakterien um die Pumpen konnte beobachtet werden. Depletion von Granulozyten führte zu einer verstärkten Infektion und zur Einwanderung von Bakterien in das den Pumpen benachbarte Gewebe.
Wie kommen wir da hin?
Wir werden osmotische Pumpen in Bakterienkulturen kolonisieren sowie Mäusen subkutan implantieren und diese für verschiedene Zeiträume untersuchen. Eine wichtige Technik zur Quantifizierung der Bakterien wird die nicht-invasive in-vivo-Bildgebung sein. So werden Bakterien eingesetzt, die eine Luciferase exprimieren und mittels des IVIS-Systems in narkotisierten Maus nachgewiesen werden können. Der quantitative Nachweis der Bakterien durch sogenanntes Ausplattieren kann hier nicht eingesetzt werden, da wir beobachtet haben, dass ein Teil der Bakterien bei der Entfernung der Pumpen aus den Tieren verloren geht. Andererseits ermöglicht es die nicht-invasive Bildgebung, die Steigerung oder Reduzierung der Bakterienzahl auf dem Implantaten in Echtzeit zu verfolgen und die Daten von einzelnen Mäusen im Zeitverlauf zu erfassen. Das IVIS wird auch zur Quantifizierung der Bakterien unter Antibiotikatherapie eingesetzt. Wir erwarten, dass die Bakterien aufgrund der Formation eines reifen Biofilms gegen Antibiotika-Behandlung resistent sind. Bei durch das Immunsystem modulierten Biofilmen könnte dies hingegen anders sein. Die Analyse wird zudem durch mikroskopische Untersuchung der kolonisierten Pumpen mit Hilfe der Light-Sheet- und Rasterelektronenmikroskopie unterstützt. Letztere liefert hochauflösende Bilder, während für die Light-Sheet-Mikroskopie Biofilme mit fluoreszierenden Antikörpern gegen Bestandteile des Biofilms oder gegen die Bakterien gefärbt werden können.
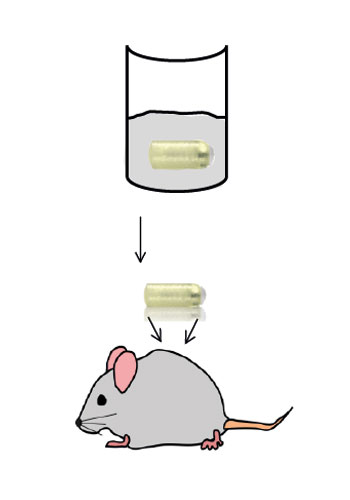
Mausmodell für Implantat-assoziierte Infektionen.